Бескислородные килоты. Пособие-репетитор по химии
15. Кислоты.Бескислородные и кислородные кислоты. Номенклатура (название кислот). Химические свойства кислот.
Кислотами называются сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться или обмениваться на атомы металла и кислотный остаток.
По наличию или отсутствию кислорода в молекуле кислоты делятся на кислородсодержащие (H2SO4 серная кислота, H2SO3 сернистая кислота, HNO3 азотная кислота, H3PO4 фосфорная кислота, H2CO3 угольная кислота, H2SiO3 кремниевая кислота) и бескислородные (HF фтороводородная кислота, HCl хлороводородная кислота (соляная кислота), HBr бромоводородная кислота, HI иодоводородная кислота, H2S сероводородная кислота).
В зависимости от числа атомов водорода в молекуле кислоты кислоты бывают одноосновные (с 1 атомом Н), двухосновные (с 2 атомами Н) и трехосновные (с 3 атомами Н). Например, азотная кислота HNO3 одноосновная, так как в молекуле её один атом водорода, серная кислота H2SO4 – Химические свойства кислот
Растворыв кислот действуют на индикаторы. Все кислоты (кроме кремниевой) хорошо растворяются в воде. Специальные вещества – индикаторы позволяют определить присутствие кислоты.
Взаимодействуют с основаниями с образованием воды и соли, в которой содержится неизменный кислотный остаток (реакция нейтрализации):
H2SO4 + Ca(OH)2 → CaSO4 + 2 H2O.
Взаимодействуют с основанными оксидами с образованием воды и соли (реакция нейтрализации). Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации:
H3PO4 + Fe2O3 → 2 FePO4 + 3 H2O. двухосновная.
Взаимодействуют с металлами. Для взаимодействия кислот с металлами должны выполнятся некоторые условия:
1. металл должен быть достаточно активным по отношению к кислотам (в ряду активности металлов он должен располагаться до водорода). Чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами;
2. кислота должна быть достаточно сильной (то есть способной отдавать ионы водорода H+).
При протекании химических реакций кислоты с металлами образуется соль и выделяется водород (кроме взаимодействия металлов с азотной и концентрированной серной кислотами,):
Zn + 2HCl → ZnCl2 + H2;
Cu + 4HNO3 → CuNO3 + 2 NO2 + 2 H2O.
16. Соли как продукты взаимодействия кислот и оснований. Типы солей: средние (нормальные), кислые, основные, оксосоли, двойные, комплексные соли. Номенклатура солей. Химические свойства солей.
Соли - это класс химических соединений, состоящих из ионов металла и ионов кислотного остатка.
Средние, или нормальные, соли - это продукты полного замещения атомов водорода в кислоте на металл.
Именно с этими солями вы уже знакомы и знаете их номенклатуру. Например:
Кислые соли - это продукты неполного замещения атомов водорода в кислоте на металл.
К кислым солям относят, например, питьевую соду, которая состоит из катиона металла и кислотного однозарядного остатка НСО3. Для кислой кальциевой соли формула записывается так: Са(НСО3)2.
Названия этих солей складываются из названий солей с прибавлением слова гидро, например:
Na2С03 - карбонат натрия, СuSO4 - сульфат меди (II) и т. д.
Диссоциируют такие соли на катионы металла и анионы кислотного остатка
Основные соли - это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
Например, к таким солям относится знаменитый малахит (СиОН)2 С03, о котором вы читали в сказах И. Бажова. Он состоит нз двух основных катионов СиОН и двухзарядного аниона кислотного остатка СО 2- 3.
Катион СuОН+ имеет заряд +1, поэтому в молекуле два таких катиона и один двухзарядный анион СО объединены в электронейтральную соль.
Названия таких солей будут такими же, как и у нормальных солей, но с прибавлением слова гидроксо-, например (СuОН)2 СО3 - гидроксокарбонат меди (II) или АlOНСl2 - гидроксохлорид алюминия. Подавляющее большинство основных солей нерастворимы или малорастворимы.
Общая формула таких кислот H х Э у. Эта группа соединений по химическим свойствам и характеру диссоциации в водных средах (образование ионов гидроксония Н 3 О +) сходна с кислородсодержащими кислотами, однако может быть выделена в отдельную группу, т.к. они не являются гидроксидами. Аналогично кислородным кислотам они могут быть различной основности.
Название по систематической номенклатуре формируют следующим образом: на первом месте стоит слово «водород» с соответствующими количественными приставками, затем следует латинское название элемента с суффиксом «ид», например:
HCl- водород хлорид
H 2 S – диводород сульфид
HSCN- водород роданид
Ниже приведены наиболее распространенные бескислородные кислоты, название по полусистематической номенклатуре их кислотных остатков и солей:
Формула Название кислоты Кислотный Название кислотного остаток остатка и соли
HF фтороводородная F - фторид-ион; фториды
(плавиковая)
HCl хлороводородная Cl - хлорид-ион; хлориды
(соляная)
HBr бромоводородная Br - бромид-ион; бромиды
HI иодоводородная I - иодид-ион; иодиды
H 2 S сероводородная S 2- сульфид-ион, сульфиды
HCN циановодородная CN - цианид-ион, цианиды
Название бескислородной кислоты : сочетание русского названия элемента и слова “водородная”. (По полусистематической номенклатуре на первом месте - название кислотного остатка + слово «водорода», например HCl-хлорид водорода, H 2 S- сульфид водорода, в современной русской учебной литературе наиболее распространены названия, которые приведены в таблице).
Название кислотного остатка : корень латинского названия элемента с суффиксом «и д».
Как и основания, все кислоты, независимо от их состава являются электролитами разной силы и подразделяют в зависимости от степени диссоциации на сильные и слабые кислоты.Следует запомнить, что сильными кислотами являются следующие: H 2 SO 4 , HCl, HBr, HJ, HNO 3 , HClO 4 , HMnO 4 . Такие кислоты, как H 2 CO 3 , H 2 S, H 2 SiO 3 , HNO 2 , H 3 BO 3 , HСlO, HCN являются наиболее распространенными слабыми.
ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ КИСЛОТ
1. Бескислородные кислоты можно получить, растворяя соответствующие газы в воде, при этом происходит диссоциация молекул на ионы:
HCl Û H + + Cl -
2. Некоторые кислородные кислоты получают при взаимодействии соответствующих оксидов с Н 2 О:
SO 3 + H 2 O = H 2 SO 4
N 2 O 5 + H 2 O = 2 HNO 3
Концентрация таких кислот может достигать 98 – 100%, в отличие, например, от соляной кислоты HCl, максимальная концентрация которой составляет 39,5% из-за ограниченной растворимости хлористого водорода HCl в Н 2 О.
3. Вытеснение слабых кислот из растворов их солей более сильными:
Na 2 CO 3 + 2 HCl = 2 NaCl + H 2 CO 3
Na 2 SiO 3 + H 2 SO 4 = Na 2 SO 4 + H 2 SiO 3 ¯
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
1.Растворы кислот характеризуются рН< 7 и изменяют окраску индикаторов:
лакмус - с фиолетового на розовый
метиловый оранжевый - с оранжевого на розовый
2. Взаимодействют с основаниями и основными оксидами:
FeO + 2 HCl = FeCl 2 + H 2 O
Cr 2 O 3 + 6 HNO 3 = 2 Cr(NO 3) 3 + 3 H 2 O
Ca(OH) 2 + H 2 SO 4 = CaSO 4 + 2 H 2 O
3. Кислоты окисляют (растворяют) металлы:
а) если окислителем в кислоте является ион Н + (HCl, H 2 SO 4 p и многие другие), они взаимодействуют с металлами, стоящими в ряду напряжений до водорода (стандартные электродные потенциалы таких металлов Е о <0):
Zn + 2 HCl = ZnCl 2 + H 2
б) если окислителем в кислоте является ее кислотный остаток (H 2 SO 4к - SO 4 2- (S +6); HNO 3 k , p - NО 3 - (N +5)), то чаще всего образуется соль, Н 2 О и продукт восстановления кислотного остатка, зависящий от активности восстановителя (например,металла):
4 Mg + 5 H 2 SO 4 k = 4 MgSO 4 + H 2 S + 4 H 2 O
Cu + 2 H 2 SO 4 k = CuSO 4 + SO 2 + 2 H 2 O
5 Mg + 12 HNO 3 p = 5 Mg(NO 3) 2 + N 2 + 6 H 2 O
3 Cu + 8 HNO 3 p = 3 Cu(NO 3) 2 + 2 NO + 4 H 2 O
5. Сильные кислоты могут окислять неметаллы и катионы некоторых металлов, например:
С + 2 H 2 SO 4 k = CO 2 + 2 SO 2 + 2 H 2 O
3 Fe(NO 3) 2 + 4 HNO 3 p = 3 Fe(NO 3) 3 + NO + 2 H 2 O
6. Взаимодействуют с солями, если образуется летучее, малорастворимое соединение, слабый электролит или комплексная частица (условие протекания реакции до конца):
BaCl 2 + H 2 SO 4 = BaSO 4 ¯ + 2 HCl
Na 2 SO 3 + 2 HCl = 2 NaCl + SO 2 + H 2 O
AuCl 3 + HCl = H
Кислоты присутствуют в живой и неживой природе и участвуют во многих химических процессах в ней. Органические и неорганические кислоты входят в состав овощей и фруктов и многих других продуктов питания. В организме человека вырабатывается соляная кислота: рН желудочного сока составляет 2 – 4, это соответствует концентрации ионов водорода [ Н + ], равной 10 -2 – 10 -4 моль/л или 3,6% – 0,036% по массе.
Контрольное задание 3:
1.Какие соединения относятся к классу гидроксидов? Дайте определение этому классу соединений.
2.Покажите с помощью химических реакций различия между свойствами оснований и кислородсодержащих кислот, объединенных в один класс соединений - гидроксидов.
3.Приведите примеры получения гидроксидов щелочных и щелочноземельных металлов, исходя из соответствующих оксидов. Запишите реакции получения (прямым или косвенным путем) соответствующих гидроксидов, если известны кислотные оксиды: SiO 2 , N 2 O 5 , CuO.
4.Докажите кислотно-основные свойства гидроксидов: CsOН, Cr(OН) 3 , Fe(OH) 2 .
5.Определите пары гидроксидов, совместное существование которых в водном растворе невозможно: NaOH- KOH, Ca(OH) 2 - KOH, Al(OH) 3 -NaOH, Zn(OH) 2 - Ca(OH) 2 . Напишите уравнения возможных реакций.
6.Расположите приведенные гидроксиды в порядке возрастания их основных свойств и поясните ваш ответ: Ga(OH) 3 , Tl(OH) 3 , In(OH) 3.
7.Назовите следующие соединения: используя все виды химических номенклатур: Сu(OH) 2 , H 2 SO 3 , H 2 Te, HCrO 3 .
8.Запишите формулы оксидов, соответствующих гидроксидам: H 3 BO 3 , HСlO, H 2 WO 4 , Fe(OH) 2 , H 3 AsO 4 ,
9.Какие из указанных веществ реагируют: а) с соляной кислотой, б) с гидрокcидом натрия: Zn(OH) 2 , H 3 PO 4 , Cu(OH) 2 , Cr(OH) 3 . Составьте уравнения реакций.
Конец работы -
Эта тема принадлежит разделу:
Периодическая система: некоторые теоретические сведения
Периодическая система некоторые теоретические сведения В периодической системы ПС можно выделить... Минимальная степень окисления металла IV VIII... минимальная степень окисления неметалла группы все неметаллы р элементы и разность представляет собой...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ:
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
Всем привет!
На улице уже похолодало...бррр. И моя кожа явно не рада такой погоде. Очень часто при резких перепадах температуры, что, собственно, и произошло недавно в моем городе, на личике моем появляются высыпания, увы... Со временем, безусловно, это проходит. Но увы, прыщики то появились. А так хочется, чтобы они быстрее ушли.
Мне повезло попробовать новую марку и незнакомое ранее для меня средство. На него я и как раз рассчитываю, свести к минимуму мои высыпания, как существующие, так и будущие.
Знакомьтесь, Кислородное умывание против угревой сыпи Acne Out от Biotrade.
ОБЩАЯ ИНФОРМАЦИЯ
- Объем: 200 мл.
- Производитель: Biotrade Bulgaria LTD, Болгария.
- Срок годности: 48 месяцев, после вскрытия гель можно использовать на протяжении 12 месяцев.
- Где купить и стоимость: Крупные косметические ИМ, а также в ИМ Great in Beauty (ссылка на страницу товара). Стоимость средства в настоящий момент 274 грн (около 580 руб). Кстати, на эту марку бывают частенько в ИМ акции, поэтому гель можно "споймать" с приятной скидкой.
Фишка этого геля, в том, что он обогащен кислородом и содержит молочную кислоту! Признаюсь, я уже и не припомню, когда у меня в последний раз была умывалка с кислотой, пусть и щадящей. Но тут еще и кислород! Впервые такое встречаю, что еще более интригует!

УПАКОВКА
Упаковка приятная глазу, в бело-гранатовой девчачьей гамме. Туба перевернутая и имеет откидную крышку. Гель извлечь не составляет труда, но можно легко переборщить с выдавленной порцией. Что собственно, и было у меня в начале использования геля при полной тубе.

Что меня удивило - наличие контроля первого вскрытия в формате, который ранее я не встречала. Место регулярного вскрытия крышки защищено пластиковой насечкой-пломбой. Добраться к гелю можно только сорвав ее. То есть я уверенна, что к гелю ничьи рученки не подбирались. Реально круто, производитель в этом плане молодец.

ОБЕЩАНИЯ ПРОИЗВОДИТЕЛЯ
Наш кислородный гель должен быть полезен коже с высыпаниями. Хотя производитель делает акцент на жирной и проблемной коже, но моей комбинированной в "период прыщиков" он здорово подошел и помог.
Что же нам обещает производитель?
- Прекрасно очистит жирную, проблемную, часто воспаляющуюся кожу.
- Избавит от излишка сальных выделений.
- Лицо приобретает свежий вид.
- Нормализуется уровень увлажненности поверхности кожи.
- Благодаря гипербарическим молекулам кислорода усиливается межклеточный метаболизм. Тем самым ускоряется процесс регенерации кожи.
Обещания хорошие, даже отличные, как раз такой микс всего нужного во время высыпаний.
СОСТАВ
Давайте заглянем в состав. Он невелик, тут нет простыни из массы ингредиентов.
Меня особенно интересовал кислород, будет ли он в нашем геле, как компонент? И да, он действительно присутствует, причем как активный ингредиент!
Aqua, Coco glucoside , Polyquaternium-37, Oxygen , Lactic acid , Parfum, Butylphenyl methylpropional, Limonene.

Активные компоненты:
Молочная кислота - увлажняющее и мягкое очищающее действие,Чистый кислород 99,9% - стимулирует восстановление и нормальный клеточный метаболизм,Coco glicoside - биоразлагаемый комплекс.
Что еще радует, так это то, что гель БЕЗ:
0% парабены, 0% сульфаты, 0% мыло, 0% силиконы
ПРИМЕНЕНИЕ
Нанести небольшое количество геля на влажную кожу и нежно втирать до появления пены. Затем тщательно промыть водой и промокнуть кожу, чтобы она стала сухой. Использовать кислородное умывания два раза в день - утром и вечером.
Мое отношение к этому гелю было более как к "лечебному средству", нежели обычной умывалке. Поэтому я не смывала этим средством макияж, даже и не пробовала. Мое очищение с ним было по схеме:
- Демакияж мицелляркой
- Умывание кислородным гелем
- Тонизирование гидролатом.
Кстати, на упаковке и в описании геля на сайте магазина, где была совершена покупка, я не увидела, что средство подходит для демакияжа. Но на просторах одного из других интернет-магазинов, мне встретилось в описании, что гель якобы хорошо убирает макияж. Возможно, но я придерживалась прямых источников, без экспериментов. К тому же, в составе, пусть и щадящая, но молочная кислота. Убирать ей макияж с глаз, к примеру, не самый лучший вариант.
ВНЕШНИЙ ВИД
Цвет
Прозрачный, без всякого рода включений. Но при выдавливании из тубы в гели местами видны пузырьки, возможно, это и есть наш кислород.

Аромат
Он присутствует, это и не удивительно, ведь в составе заявлена отдушка. Описать запах этот довольно трудно. Скажу так - этакий запах свежести. Он не вызывает у меня неприязни, но и восторга тоже с ним у меня не было.
Консистенция и текстура
Средство представляет собой классический гель. Вязкий, не жидкий. Если нанести на кожу рук из тубы, не растекается.

Пенообразование среднее, пышной пены здесь не будет. Но для процесса умывания ее достаточно, все в меру.

МОЯ КОЖА
Благо я не страдаю угревой сыпью, высыпания, как правило, появляются один раз в месяц. Но порой, как в этот раз, бывают непредвиденные воспаления, причина появления которых обычно мне ясна.
Моя кожа - комбинированная. Жирная в Т-зоне, нормальная на остальных участках. В Т-зоне периодически могут появиться высыпания. На носу расширенные поры с многочисленными черными точками и сальными пробками.
МОИ ВПЕЧАТЛЕНИЯ
Я использовала гель два раза в день - утром и вечером. Причем я раньше могла игнорировать умывание утром, обходясь только плюхом водички в личико и протиранием кожи тоником. В случае с этим гелем я перестроила свой обыденный косметический ритуал умывания. Почему? Мне очень понравилось ощущение на моей коже после применения этого геля. Рука каждый раз прямо сама тянется а нему, причем я не преувеличиваю.
Для умывания необходимо небольшое количество геля. Предварительно увлажняю лицо и руки водой. Выдавливаю небольшое количество средства и переношу его на кожу лица. И непосредственно на лице уже вспениваю гель. И так массирую себя минуту. Ну и смываю гель, легко, без заморочек и спонжика.
И что мы имеем?
Кожа после умывания гелем словно дышит! Именно так, чувствуется, что кожа очищена, но не пересушена и не стянута ! Кажется, что сняли какую-то маску или пелену с лица.
Кожа выглядит посвежевшей, общий тон лица словно выравнивается .
После очищения гелем кожа становится матовой и гладенькой . Никакого намека на жирный блеск! Причем эта матовость сохраняется долго . Утром умылась, и только где-то к 15.00 я иду за матирующими салфетками.
Но! Непосредственно сразу после умывания при прикосновении присутствует липкость. Как-то странно, если честно. Ибо ранее у меня на практике было так - если средство давало липкость, то и на лице было ощущение пелены. Но с нашим гелем наоборот - свежесть на лице, но и минутная липкость при соприкосновении. Да, именно минутная. Ибо через минуту-две липкость сходит сама на нет. Если протирать после умывания кожу сразу тоником или гидролатом, тогда липкость уходит сразу, вместе с последним взмахом ватного диска.
Вообщем, дискомфорта в этом для меня нет. Я то и обратила на этот момент внимание, когда уже раз 5 умывалась гелем. Тем не менее, упомянуть считаю нужным.
При регулярном применении геля количество черных точек и прыщиков у меня действительно стало заметно меньше . Они не сошли совсем полностью, нет, хотя я была бы в восторге. Но то, что их стало меньше, факт. Особенно это видно в моей зоне скул и щек. Именно эти зоны внезапно были атакована воспалениями и черными точками.
Вот что имею как результат на сегодняшний день.

Могу предположить, что гель, матируя, действительно минимизирует количество кожного жира. Соответственно, меньше связанного с этим кожных проблем.
Те высыпания, которые присутствовали на момент начала применения геля, не прошли быстрее. Но вот след от них, пятнышки, сошли довольно быстро.
Единственное, я не увидела особых улучшений в моей проблемной зоне носа. За время использования геля прыщиков здесь не появлялось, вроде сальных пробок стало меньше, но ни так, чтобы я прямо пищала от восторга. Если Вам интересно, вот о моем бедном носе и не очень удачных Белитовских полосках от черных точек из серии Black Clean.
Ну и о расходе, который за счет вязковатой текстуры средства оказался весьма небольшим. За три недели регулярного использования геля у меня не ушло и половины тубы.
★☆★☆★☆★☆★......
Подводя итог, отмечу, что мое знакомство с маркой Biotrade и гелем из серии Acne Оut прошло удачно. Средство действительно рабочее, и стало одним из моих помощником в борьбе за чистую кожу.
Давайте резюмировать:
✔ Приятный состав с молочной кислотой и чистым кислородом.
✔ Без парабенов, сульфатов и мыла.
✔ Имеет действительно эффективный контроль первого вскрытия.
✔ Прекрасно очищает, убирает жирный блеск и матирует кожу. Причем этот эффект сохраняется довольно долго!
✔ Не сушит и не стягивает кожу.
✔ Кожа выглядит посвежевшей и по ощущениям словно "дышит".
✔ Действительно минимизирует количество воспалений и черных точек.
![]()
Напоследок от себя отмечу, что всегда нужно понимать причину высыпаний. Ибо одна умывашка, даже самая удачная, не справится в таком деле. Гель для умывания - это коррекция, а вот какие корректирующие действия в борьбе за чистую кожу предпринять, будет зависеть от каждого конкретного случая.
Если вы в поисках умывашки, которая не будет сушить кожу, при этом подарит матовость, здоровый вид кожи, поможет минимизировать высыпания, тогда я Вам рекомендую попробовать Кислородное умывание от марки Biotrade.
И.В.ТРИГУБЧАК
Пособие-репетитор по химии
Продолжение. Начало см. в № 22/2005; 1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18, 22/2006;
3, 4/2007
ЗАНЯТИЕ 17
10-й класс
(первый год обучения)
(Кислоты-окислители подробнее рассматриваются отдельно.)
План
1. Определение, строение молекулы (графические формулы).
2. Классификации (по основности, по силе электролитической диссоциации, по содержанию кислорода).
3. Физические свойства.
4. Химические свойства.
5. Методы получения кислородсодержащих, бескислородных кислот и кремниевой кислоты.
6. Области применения.
Кислоты – сложные вещества, состоящие из атомов водорода и простого или сложного кислотного остатка. Валентность кислотного остатка определяется числом атомов водорода в формульной единице кислоты:
![]()
При составлении графических формул кислот необходимо помнить, что в кислородсодержащих кислотах атом кислотообразующего элемента связывается с атомами водорода через атомы кислорода. Так, графические формулы кислот HCl, H 2 SO 4 , H 3 PO 4 следующие:
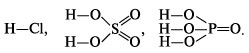
К л а с с и ф и к а ц и я к и с л о т
По основности кислоты бывают одноосновные (HCl), двухосновные (H 2 SO 4), трехосновные (H 3 PO 4), четырехосновные (H 4 P 2 O 7) – по числу атомов водорода в кислоте.
По силе электролитической диссоциации кислоты подразделяют на сильные и слабые электролиты. Ряд активности кислот выглядит следующим образом:
сильные – HI, HBr, HСlO 4 , HCl, H 2 SO 4 , HMnO 4 , HNO 3 , H 2 Cr 2 O 7 ;
средние – H 2 CrO 4 , H 2 SO 3 , H 3 PO 4 , HF, HNO 2 ;
слабые – CH 3 COOH, H 2 CO 3 , H 2 S, H 3 BO 3 ;
очень слабые – HCN, H 2 SiO 3 .
Ф и з и ч е с к и е с в о й с т в а
Кислоты могут быть твердыми (ортофосфорная, борная, йодная) и жидкими (серная, азотная). Кремниевая кислота – гелеобразная. Большинство кислот хорошо растворимы в воде. Растворы кислот едкие, кислые на вкус.
Х и м и ч е с к и е с в о й с т в а к и
с л о т
(не окислителей)
Диссоциация, например:
HCl H + + Cl – .
С водородом и кислородом кислоты не взаимодействуют.
Металлы, расположенные в ряду напряжений левее водорода, вытесняют его из растворов кислот, например:
2HCl + Zn = ZnCl 2 + H 2 .
Неметаллы обычно не реагируют с кислотами, например:
Н 2 SO 4 + Cl 2 ... .
Однако в специфических случаях подобные реакции возможны, например:
2HBr + Cl 2 = 2HCl + Br 2 .
Кислоты не реагируют с водой, кислотными оксидами и другими кислотами.
Кислоты взаимодействуют с основными оксидами и с основаниями, например:
2HCl + СаО = СaCl 2 + H 2 O,
2HCl + Са(ОН) 2 = СaCl 2 + 2H 2 O.
Кислоты взаимодействуют с солями по типу реакции обмена в тех случаях, когда выделяется газ, получается вода или образуется осадок, например:
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2 ,
BaCl 2 + H 2 SO 4 = BaSO 4 + 2HCl.
При нагревании кислоты разлагаются, например:
H 2 SiO 3 H 2 O + SiO 2 .
Индикаторы изменяют окраску в растворах кислот.
М е т о д ы п о л у ч е н и я кислот различаются в зависимости от наличия или отсутствия кислорода в кислоте.
SO 3 + H 2 O = H 2 SO 4 .
Исключение составляет кремниевая кислота, которую получают реакцией обмена:
Na 2 SiO 3 + 2HCl = 2NaCl + H 2 SiO 3 .
Бескислородные кислоты получают реакцией между соответствующими простыми веществами и последующим растворением полученного вещества в воде (физический процесс), например:
При растворении газа H 2 S в воде получается раствор сероводородной кислоты.
О б л а с т и п р и м е н е н и я. Кислоты применяют в технике, в пищевой отрасли промышленности, в медицине, для производства товаров бытовой химии, в химическом синтезе для получения новых веществ.
Тест по теме «Кислоты»
1. Укажите самую слабую из перечисленных кислот:
а) сероводородная; б) серная;
в) селеновая; г) сернистая.
2. Среди перечисленных наборов веществ укажите тот, в котором есть вещества, реагирующие друг с другом:
а) сульфид железа(II) и сульфид свинца;
б) сульфат натрия и хлорид бария;
в) гидроксид калия и гидроксид железа(II);
г) карбонат калия и серная кислота.
3. Формула высшего оксида элемента Х 2 О 3 . Какая из перечисленных кислот может соответствовать этому оксиду?
а) Н 2 Х 4 О 7 ; б) Н 2 Х 2 О 3 ; в) Н 2 ХО 4 ; г) Н 4 Х 2 О 6 .
4. Какое вещество под действием соляной кислоты превращается в хлорид меди(II)?
а) медь; б) бромид меди(II);
в) оксид меди(II); г) сульфат меди(II).
5. Ортофосфорная кислота реагирует с:
а) медью при нагревании;
б) аммиаком;
в) гидроксидом калия;
г) нашатырным спиртом.
6. Кислота, которая не может образовывать кислые соли, это:
а) сернистая; б) уксусная;
в) угольная; г) азотистая.
7. Простое вещество содержит элемент Х, входящий в состав щитовидной железы. При взаимодействии Х с газообразным веществом Y образуется сильная кислота Z. Эта кислота вступает в реакцию обмена с нитратом драгоценного металла с образованием желтого осадка. Кислота Z называется:
а) сероводородная; б) хлороводородная;
в) йодоводородная; г) бромоводородная.
8. В четырех пробирках находятся водные растворы сульфита, сульфида, сульфата и силиката натрия. С помощью какого одного реактива можно определить эти вещества?
а) Гидроксид натрия; б) соляная кислота;
в) хлорид бария; г) фенолфталеин.
9. В состав средства для удаления накипи («антинакипина») входят:
а) щелочи; б) пищевая сода;
в) кислоты; г) все перечисленное.
10. Смешали 0,5 л 7%-й серной кислоты ( = 1,046 г/мл) и 150 г 25%-й серной кислоты. Массовая доля (в %) кислоты в полученном растворе составляет:
а) 10; б) 11; в) 40; г) 48.
Ключ к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| а | б, г | а | в | б, в, г | б, г | в | б | в | б |
Задачи на кристаллогидраты
У р о в е н ь А
1. 5 г медного купороса растворили в 5 моль воды. Рассчитать массовую долю соли в полученном растворе.
Дано:
m(CuSO 4 5H 2 O) = 5 г,
(H 2 O) = 5 моль.
Найти:
Решение
(CuSO 4 5H 2 O) = m (CuSO 4 5H 2 O)/M (CuSO 4 5H 2 O) = 5/250 = 0,02 моль,
(CuSO 4) = (CuSO 4 5H 2 O) = 0,02 моль;
m (CuSO 4) = (CuSO 4)М (CuSO 4) = 0,02 160 = 3,2 г;
(CuSO 4)
= m
(CuSO 4)/m
(р-ра) = = 0,0337, или
3,37%.
Ответ . 3,37%.
2. Для приготовления 5%-го раствора сульфата магния взято 400 г его гептагидрата. Найти массу полученного раствора.
Ответ . 3,9 кг.
3. Определить массовую долю сульфата меди в растворе, полученном при растворении 50 г медного купороса в 450 г воды.
Ответ . 6,4%.
4. В какой массе воды нужно растворить 25 г медного купороса для получения 8%-го раствора соли?
Ответ . 175 г.
5. Какую массу декагидрата сульфата натрия нужно растворить в 800 г воды, чтобы получить 10%-й раствор соли?
Ответ . 234,6 г.
6. Определить формулу кристаллогидрата хлорида кальция, если 2,22 г безводной соли образует с водой 4,38 г кристаллогидрата.
Ответ . Гексагидрат CaCl 2 6H 2 O.
7. Содержание кристаллизационной воды в кристаллогидрате сульфата железа(II) составляет 45,32% его массы. Определить формулу этого кристаллогидрата.
Ответ . Гептагидрат FeSO 4 7H 2 O.
8. Какова процентная концентрация раствора хлорида кальция, полученного растворением 21,9 г его гексагидрата в 100 мл воды?
Ответ . 9,1%.
9. Определить состав кристаллогидрата сульфата натрия, если известно, что при нагревании 80,5 г кристаллогидрата до 300 °С масса испарившейся воды составила 45 г. Какова массовая доля раствора, полученного при растворении 80,5 г данного криталлогидрата в 2 л воды?
Ответ . Декагидрат Na 2 SO 4 10H 2 O; = 1,7%.
У р о в е н ь Б
1. 27,84 г частично обезвоженной кристаллической соды с избытком соляной кислоты выделяет 2,683 л (н.у.) углекислого газа. Найти формулу частично обезвоженной соды. Определить, сколько процентов воды потеряла кристаллическая сода при частичном обезвоживании.
Ответ . Гептагидрат Na 2 CO 3 7H 2 O; 18,9%.
2. При растворении 28 г неизвестного металла в разбавленной серной кислоте выделяется 11,2 л газа и образуется сульфат металла, из которого получается 139 г кристаллогидрата. Определить формулу полученного кристаллогидрата.
Ответ . Гептагидрат FeSO 4 7H 2 O.
3. Смесь кристаллогидратов медного и железного купоросов массой 3,89 г растворили в воде и добавили к раствору избыток хлорида бария. Выпало 3,5 г осадка. Определить состав исходной смеси.
Ответ
. 64,3% CuSO 4 5H 2 O
и 35,7% FeSO 4 7H 2 O.
4. Из 500 г 40%-го раствора сульфата железа(II) при охлаждении выпало 100 г его гептагидрата. Какова массовая доля вещества в оставшемся растворе?
Ответ . 36,3%.
5. Какую массу тетрагидрата нитрата кальция нужно растворить в 75 г 2%-го раствора нитрата кальция для получения раствора с молярной концентрацией 0,948 моль/л ( = 1,11 г/мл)?
Ответ . 16,2 г.
6. К 400 мл раствора дихромата натрия с концентрацией 0,238 моль/л ( = 1,041 г/мл) добавили 40 г кристаллогидрата этой соли. Массовая доля соли в растворе стала равна 13,17%. Установить состав кристаллогидрата.
Ответ . Дигидрат Na 2 Cr 2 O 7 2H 2 O.
7. Необходимо приготовить 1 кг 20%-го раствора соли. Сколько граммов ее кристаллогидрата и воды потребуется для этого, если известно, что в кристаллогидрате соли содержится на 79,5% больше, чем воды?
Ответ
. 222,84 г кристаллогидрата
и 777,15 г воды.
8. К 15%-му раствору ацетата свинца добавили 20 г кристаллогидрата этой соли. Полученный раствор имел массу 150 г и содержал 24,43% ацетата свинца. Установить формулу кристаллогидрата.
Ответ . Тригидрат Pb(CH 3 COO) 2 3H 2 O.
9. К 200 г 20%-го раствора нитрата цинка добавили 40 г кристаллогидрата этой соли. Концентрация соли в полученном растворе составила 27,27%. Установить формулу кристаллогидрата.
Ответ . Гексагидрат Zn(NO 3) 2 6H 2 O.
10. Дана смесь, в которой количества веществ хлорида натрия и кристаллогидрата бромида натрия равны между собой. Массовая доля поваренной соли в смеси составляет 29,6%. Установить состав кристаллогидрата.
Ответ . Дигидрат NaBr 2H 2 O.
11. Чтобы получить смесь оксида хрома(III) и кристаллогидрата сульфата хрома(III) с равными массовыми долями этих двух соединений, количество вещества оксида было взято в 4,71 раза больше, чем кристаллогидрата. Установить состав кристаллогидрата.
Ответ . 6,75%.
13. Какой объем 5%-го раствора сульфата натрия надо взять, чтобы растворение в нем 150 г декагидрата сульфата натрия привело к образованию 14%-го раствора? Плотности растворов равны соответственно 1,044 г/мл и 1,131 г/мл.
Ответ . 480,5 мл.
Продолжение следует


