Кислородсодержащие кислоты таблица. Бескислородные килоты
Общая формула таких кислот H х Э у. Эта группа соединений по химическим свойствам и характеру диссоциации в водных средах (образование ионов гидроксония Н 3 О +) сходна с кислородсодержащими кислотами, однако может быть выделена в отдельную группу, т.к. они не являются гидроксидами. Аналогично кислородным кислотам они могут быть различной основности.
Все эти конфигурации вызваны взаимодействием как внутри одной белковой цепи, так и между двумя или тремя отдельными нитями белка. Подобно тому, как белки образуются при соединении аминокислот с образованием длинных цепей, их можно разбить на отдельные аминокислоты реакцией, называемой гидролизом. Эта реакция является лишь обратной формой образования пептидной связи. В процессе переваривания белки снова разбиваются на отдельные аминокислотные компоненты. Специальные пищеварительные ферменты необходимы, чтобы вызвать разрыв пептидной связи, и при реакции происходит добавление молекулы воды.
Название по систематической номенклатуре формируют следующим образом: на первом месте стоит слово «водород» с соответствующими количественными приставками, затем следует латинское название элемента с суффиксом «ид», например:
HCl- водород хлорид
H 2 S – диводород сульфид
HSCN- водород роданид
Ниже приведены наиболее распространенные бескислородные кислоты, название по полусистематической номенклатуре их кислотных остатков и солей:
Полученные аминокислоты высвобождаются в тонкую кишку, где они могут легко проникать в кровоток и переноситься в каждую клетку организма. Клетка может использовать эти аминокислоты для сборки новых и разных белков, необходимых для ее конкретных функций.
Из 20 аминокислот, необходимых человеку для производства белка, 12 из них могут быть сделаны в организме из других питательных веществ. Другие восемь, называемые незаменимыми аминокислотами, не могут быть получены организмом и должны быть получены из рациона. Это изолейцин, лейцин, лизин, метионин, фенляланин, треонин, триптофан и валин. Кроме того, считается, что аргинин и гистидин являются важными для роста детей, но не могут быть важными для взрослых взрослых. Соответствующим белком является тот, который содержит все необходимые аминогруппы.
Формула Название кислоты Кислотный Название кислотного остаток остатка и соли
HF фтороводородная F - фторид-ион; фториды
(плавиковая)
HCl хлороводородная Cl - хлорид-ион; хлориды
(соляная)
HBr бромоводородная Br - бромид-ион; бромиды
HI иодоводородная I - иодид-ион; иодиды
H 2 S сероводородная S 2- сульфид-ион, сульфиды
Альфа-атом углерода - атом углерода, смежный с карбоксильной группой. Существенная аминокислота - аминокислоты, которые не могут быть синтезированы организмом и должны быть получены из рациона. Мономеры. Небольшие индивидуальные субъединицы, которые объединяются для образования полимеров.
Пептид. Вещества, состоящие из цепей аминокислот, обычно меньше. Пептидная связь. Связывание, образованное, когда карбоксильная группа одной аминокислоты соединяется с аминогруппой второй аминокислоты и отщепляется от молекулы воды. Кислот в достаточных количествах для роста и восстановления ткани тела. Большинство белков из животных источников содержат все незаменимые аминокислоты и считаются адекватными белками. Многие растительные белки не содержат всех незаменимых аминокислот. Например, кукуруза не содержит незаменимых аминокислот лизина и триптофана.
HCN циановодородная CN - цианид-ион, цианиды
Название бескислородной кислоты : сочетание русского названия элемента и слова “водородная”. (По полусистематической номенклатуре на первом месте - название кислотного остатка + слово «водорода», например HCl-хлорид водорода, H 2 S- сульфид водорода, в современной русской учебной литературе наиболее распространены названия, которые приведены в таблице).
Рис отсутствует в лизине и треонине; в лизине отсутствует пшеница; и соевые бобы отсутствуют в метионине. Люди, которые являются вегетарианцами и не потребляют животных белков в своих диетах, иногда страдают от недоедания из-за отсутствия одной или нескольких аминокислот в их рационах, даже если они могут потреблять достаточное количество пищи и много калорий. Недоедание можно избежать, зная, какие комбинации растительных белков будут поставлять все необходимые аминокислоты.
Поскольку каждый стиль имеет свои собственные нюансы форматирования, которые эволюционируют с течением времени, и не вся информация доступна для каждой ссылки или статьи, сайт не может гарантировать, что каждая цитата создается. Поэтому лучше всего использовать цитирование сайта в качестве отправной точки, прежде чем проверять стиль на соответствие требованиям вашей школы или публикации и самую последнюю информацию, доступную на этих сайтах.
Название кислотного остатка : корень латинского названия элемента с суффиксом «и д».
Как и основания, все кислоты, независимо от их состава являются электролитами разной силы и подразделяют в зависимости от степени диссоциации на сильные и слабые кислоты.Следует запомнить, что сильными кислотами являются следующие: H 2 SO 4 , HCl, HBr, HJ, HNO 3 , HClO 4 , HMnO 4 . Такие кислоты, как H 2 CO 3 , H 2 S, H 2 SiO 3 , HNO 2 , H 3 BO 3 , HСlO, HCN являются наиболее распространенными слабыми.
Поэтому не забудьте обратиться к этим рекомендациям при редактировании своей библиографии или списка цитируемых работ. Однако часто бывает важна дата поиска. . Кроме того, в этом анионе отрицательный заряд распределяется симметрично между двумя атомами кислорода, так что углерод-кислородные связи приобретают характер частично двойной связи.
Как правило, карбоновые кислоты представляют собой слабые кислоты, причем только 1% их молекул диссоциируют с получением соответствующего, при комнатной температуре и в водном растворе. Но они более кислые, чем другие, в которых эта электронная делокализация не происходит, например, спирты. Например, тот, который назван ацетатным ионом.
ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ КИСЛОТ
1. Бескислородные кислоты можно получить, растворяя соответствующие газы в воде, при этом происходит диссоциация молекул на ионы:
HCl Û H + + Cl -
2. Некоторые кислородные кислоты получают при взаимодействии соответствующих оксидов с Н 2 О:
SO 3 + H 2 O = H 2 SO 4
N 2 O 5 + H 2 O = 2 HNO 3
Концентрация таких кислот может достигать 98 – 100%, в отличие, например, от соляной кислоты HCl, максимальная концентрация которой составляет 39,5% из-за ограниченной растворимости хлористого водорода HCl в Н 2 О.
Карбоновые кислоты реагируют с образованием. Таким образом, уксусная кислота реагирует с бикарбонатом натрия, получая ацетат натрия, диоксид углерода и воду. Карбоксильные группы реагируют с аминогруппами с образованием. В случае, когда они взаимодействуют с другими аминокислотами, образуется связь амидного типа, которая образуется. Аналогично, карбоновые кислоты могут вступать в реакцию со спиртами с образованием галогенидов с образованием галогенангидридов или друг с другом для получения ангидридов.
Эфиры, галогениды кислот и называются кислотными производными. Названия карбоновых кислот обозначают в соответствии с природным источником, из которого они были первоначально выделены. В системе названия карбоновых кислот образуются путем замены о окончания алканов на «оико» и помещения слова «кислота».
3. Вытеснение слабых кислот из растворов их солей более сильными:
Na 2 CO 3 + 2 HCl = 2 NaCl + H 2 CO 3
Na 2 SiO 3 + H 2 SO 4 = Na 2 SO 4 + H 2 SiO 3 ¯
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
1.Растворы кислот характеризуются рН< 7 и изменяют окраску индикаторов:
лакмус - с фиолетового на розовый
метиловый оранжевый - с оранжевого на розовый
2. Взаимодействют с основаниями и основными оксидами:
Примеры карбоновых кислот
Слишком много свободных радикалов в организме может вызвать преждевременное старение. Свободные радикалы представляют собой атомы или группы атомов, которые имеют один или несколько свободных электронов. Они являются результатом гомолитических расщеплений, т.е. справедливых разрывов ковалентных связей, где каждый атом связи остается одним из электронов, которые ранее были разделены в связи. Например, наблюдайте ниже молекулу хлорметана, в которой присутствует ковалентная связь, то есть пара электронов, разделяемая между углеродом и хлором.
FeO + 2 HCl = FeCl 2 + H 2 O
Cr 2 O 3 + 6 HNO 3 = 2 Cr(NO 3) 3 + 3 H 2 O
Ca(OH) 2 + H 2 SO 4 = CaSO 4 + 2 H 2 O
3. Кислоты окисляют (растворяют) металлы:
а) если окислителем в кислоте является ион Н + (HCl, H 2 SO 4 p и многие другие), они взаимодействуют с металлами, стоящими в ряду напряжений до водорода (стандартные электродные потенциалы таких металлов Е о <0):
Zn + 2 HCl = ZnCl 2 + H 2
Обратите внимание, что если эта связь нарушается каким-то фактором, например световой энергией, углерод будет иметь свободный электрон и хлор. Следовательно, произойдет гомолитическое расщепление или гомолиз. Таким образом, следует иметь в виду, что свободные радикалы являются нейтральными химическими веществами и их не следует путать с ионами, которые являются электрически заряженными структурами. Ионы являются результатом гетеролитического разрушения, т.е. когда происходит ковалентная связь, и один из атомов остается с двумя ранее разделенными электронами.
б) если окислителем в кислоте является ее кислотный остаток (H 2 SO 4к - SO 4 2- (S +6); HNO 3 k , p - NО 3 - (N +5)), то чаще всего образуется соль, Н 2 О и продукт восстановления кислотного остатка, зависящий от активности восстановителя (например,металла):
4 Mg + 5 H 2 SO 4 k = 4 MgSO 4 + H 2 S + 4 H 2 O
Cu + 2 H 2 SO 4 k = CuSO 4 + SO 2 + 2 H 2 O
5 Mg + 12 HNO 3 p = 5 Mg(NO 3) 2 + N 2 + 6 H 2 O
3 Cu + 8 HNO 3 p = 3 Cu(NO 3) 2 + 2 NO + 4 H 2 O
Этот атом становится анионом, потому что он становится отрицательно заряженным, а другой атом, потерявший электрон, становится катионом, потому что он заряжен положительно. Свободные радикалы очень важны при изучении органической химии, и большинство из них образованы только углеродом и водородом. В этих случаях свободные радикалы можно классифицировать как одновалентные и как двухвалентные.
Подробнее об этом читайте в тексте «Органическая номенклатура». Важно это знать, потому что свободные радикалы очень нестабильны, то есть имеют короткую жизнь, именно потому, что у них есть свободные валентности. Но электроны всегда стремятся группироваться парами как в орбиталях атомов, так и в ковалентных связях. Таким образом, неспаренные электроны радикалов активно взаимодействуют с любыми соседними молекулами, образуя новые соединения. Ветви различных органических молекул являются примерами радикалов, которые связаны.
5. Сильные кислоты могут окислять неметаллы и катионы некоторых металлов, например:
С + 2 H 2 SO 4 k = CO 2 + 2 SO 2 + 2 H 2 O
3 Fe(NO 3) 2 + 4 HNO 3 p = 3 Fe(NO 3) 3 + NO + 2 H 2 O
6. Взаимодействуют с солями, если образуется летучее, малорастворимое соединение, слабый электролит или комплексная частица (условие протекания реакции до конца):
BaCl 2 + H 2 SO 4 = BaSO 4 ¯ + 2 HCl
Таким образом, свободные радикалы могут действовать как окислители, получая как электроны, так и восстанавливающие агенты, пожертвовав электроны. Нарушение связей, образующих радикалы, а также связей, которые образуют радикалы, является основой для объяснения механизма органических реакций.
Примером образования свободных радикалов является наше дыхание, что является совершенно противоположным процессом фотосинтеза, то есть глюкоза, которую мы получаем в пище, реагирует с кислородом, и это сжигание высвобождает энергию в клетки нашего организма, а также диоксид углерод и вода.
Na 2 SO 3 + 2 HCl = 2 NaCl + SO 2 + H 2 O
AuCl 3 + HCl = H
Кислоты присутствуют в живой и неживой природе и участвуют во многих химических процессах в ней. Органические и неорганические кислоты входят в состав овощей и фруктов и многих других продуктов питания. В организме человека вырабатывается соляная кислота: рН желудочного сока составляет 2 – 4, это соответствует концентрации ионов водорода [ Н + ], равной 10 -2 – 10 -4 моль/л или 3,6% – 0,036% по массе.
Это очень важная и необходимая реакция на наше выживание. Но сжигание в клетках также образует много промежуточных звеньев, в том числе свободных радикалов. Формирование свободных радикалов также важно для организма в том смысле, что они могут взаимодействовать насильственным и неизбирательным образом, когда инородные тела входят в наше тело и сражаются с ними.
Они также реагируют с холестерином, который считается плохой для нашего организма, который является липопротеином низкой плотности, окисляя этот липид и превращая его в инородное тело, на которое нападают. Эта дестабилизация этих соединений приводит к появлению нескольких дегенеративных заболеваний, таких как болезнь Альцгеймера и преждевременное старение.
Контрольное задание 3:
1.Какие соединения относятся к классу гидроксидов? Дайте определение этому классу соединений.
2.Покажите с помощью химических реакций различия между свойствами оснований и кислородсодержащих кислот, объединенных в один класс соединений - гидроксидов.
3.Приведите примеры получения гидроксидов щелочных и щелочноземельных металлов, исходя из соответствующих оксидов. Запишите реакции получения (прямым или косвенным путем) соответствующих гидроксидов, если известны кислотные оксиды: SiO 2 , N 2 O 5 , CuO.
Наше тело имеет некоторые защитные ферменты, которые борются с чрезмерным образованием свободных радикалов. Но со старением организм теряет способность защищаться. Поэтому очень важно постоянно питаться продуктами, называемыми антиоксидантами, которые являются теми, кто борется со свободными радикалами, потому что они реагируют на них, нейтрализуя их.
Кислород является неотъемлемым элементом жизни, мы не можем обойтись без него, но он порождает в организме производные, которые каждый день наносят ущерб нашим клеткам. Эти производные называются реактивными видами кислорода. Клетки содержат органеллы, называемые митохондриями, которые обеспечивают энергию, необходимую клеткам. Митохондрии являются, в некотором роде, электростанциями наших клеток. Чем больше энергии требуется клетке для ее работы, тем больше она содержит митохондрии. В этих органеллах существует серия очень сложных реакций, которые прекрасно известны сегодня.
4.Докажите кислотно-основные свойства гидроксидов: CsOН, Cr(OН) 3 , Fe(OH) 2 .
5.Определите пары гидроксидов, совместное существование которых в водном растворе невозможно: NaOH- KOH, Ca(OH) 2 - KOH, Al(OH) 3 -NaOH, Zn(OH) 2 - Ca(OH) 2 . Напишите уравнения возможных реакций.
6.Расположите приведенные гидроксиды в порядке возрастания их основных свойств и поясните ваш ответ: Ga(OH) 3 , Tl(OH) 3 , In(OH) 3.
Балансом этих реакций является сжигание сахаров и жиров, которые выделяют энергию. Именно эта энергия позволяет нашим мышцам сжиматься. К сожалению, реакционная цепь наших митохондрий несовершенна и приводит к образованию активных форм кислорода, включая свободные радикалы.
Свободный радикал - это химический вид, который имеет единственный электрон, который непатен. Эта характеристика делает ее нестабильной и дает высокую реакционную способность к окружающим молекулам. Свободный радикал стабилизируется за счет соседней молекулы, которая, в свою очередь, становится свободным радикалом и так далее. Явление распространено цепными реакциями.
7.Назовите следующие соединения: используя все виды химических номенклатур: Сu(OH) 2 , H 2 SO 3 , H 2 Te, HCrO 3 .
8.Запишите формулы оксидов, соответствующих гидроксидам: H 3 BO 3 , HСlO, H 2 WO 4 , Fe(OH) 2 , H 3 AsO 4 ,
9.Какие из указанных веществ реагируют: а) с соляной кислотой, б) с гидрокcидом натрия: Zn(OH) 2 , H 3 PO 4 , Cu(OH) 2 , Cr(OH) 3 . Составьте уравнения реакций.
Конец работы -
Эта тема принадлежит разделу:
Периодическая система: некоторые теоретические сведения
Периодическая система некоторые теоретические сведения В периодической системы ПС можно выделить... Минимальная степень окисления металла IV VIII... минимальная степень окисления неметалла группы все неметаллы р элементы и разность представляет собой...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ:
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
И.В.ТРИГУБЧАК
Пособие-репетитор по химии
Продолжение. Начало см. в № 22/2005; 1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18, 22/2006;
3, 4/2007
ЗАНЯТИЕ 17
10-й класс
(первый год обучения)
(Кислоты-окислители подробнее рассматриваются отдельно.)
План
1. Определение, строение молекулы (графические формулы).
2. Классификации (по основности, по силе электролитической диссоциации, по содержанию кислорода).
3. Физические свойства.
4. Химические свойства.
5. Методы получения кислородсодержащих, бескислородных кислот и кремниевой кислоты.
6. Области применения.
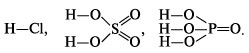
Кислоты – сложные вещества, состоящие из атомов водорода и простого или сложного кислотного остатка. Валентность кислотного остатка определяется числом атомов водорода в формульной единице кислоты:
![]()
При составлении графических формул кислот необходимо помнить, что в кислородсодержащих кислотах атом кислотообразующего элемента связывается с атомами водорода через атомы кислорода. Так, графические формулы кислот HCl, H 2 SO 4 , H 3 PO 4 следующие:
К л а с с и ф и к а ц и я к и с л о т
По основности кислоты бывают одноосновные (HCl), двухосновные (H 2 SO 4), трехосновные (H 3 PO 4), четырехосновные (H 4 P 2 O 7) – по числу атомов водорода в кислоте.
По силе электролитической диссоциации кислоты подразделяют на сильные и слабые электролиты. Ряд активности кислот выглядит следующим образом:
сильные – HI, HBr, HСlO 4 , HCl, H 2 SO 4 , HMnO 4 , HNO 3 , H 2 Cr 2 O 7 ;
средние – H 2 CrO 4 , H 2 SO 3 , H 3 PO 4 , HF, HNO 2 ;
слабые – CH 3 COOH, H 2 CO 3 , H 2 S, H 3 BO 3 ;
очень слабые – HCN, H 2 SiO 3 .
Ф и з и ч е с к и е с в о й с т в а
Кислоты могут быть твердыми (ортофосфорная, борная, йодная) и жидкими (серная, азотная). Кремниевая кислота – гелеобразная. Большинство кислот хорошо растворимы в воде. Растворы кислот едкие, кислые на вкус.
Х и м и ч е с к и е с в о й с т в а к и
с л о т
(не окислителей)
Диссоциация, например:
HCl H + + Cl – .
С водородом и кислородом кислоты не взаимодействуют.
Металлы, расположенные в ряду напряжений левее водорода, вытесняют его из растворов кислот, например:
2HCl + Zn = ZnCl 2 + H 2 .
Неметаллы обычно не реагируют с кислотами, например:
Н 2 SO 4 + Cl 2 ... .
Однако в специфических случаях подобные реакции возможны, например:
2HBr + Cl 2 = 2HCl + Br 2 .
Кислоты не реагируют с водой, кислотными оксидами и другими кислотами.
Кислоты взаимодействуют с основными оксидами и с основаниями, например:
2HCl + СаО = СaCl 2 + H 2 O,
2HCl + Са(ОН) 2 = СaCl 2 + 2H 2 O.
Кислоты взаимодействуют с солями по типу реакции обмена в тех случаях, когда выделяется газ, получается вода или образуется осадок, например:
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2 ,
BaCl 2 + H 2 SO 4 = BaSO 4 + 2HCl.
При нагревании кислоты разлагаются, например:
H 2 SiO 3 H 2 O + SiO 2 .
Индикаторы изменяют окраску в растворах кислот.
М е т о д ы п о л у ч е н и я кислот различаются в зависимости от наличия или отсутствия кислорода в кислоте.
SO 3 + H 2 O = H 2 SO 4 .
Исключение составляет кремниевая кислота, которую получают реакцией обмена:
Na 2 SiO 3 + 2HCl = 2NaCl + H 2 SiO 3 .
Бескислородные кислоты получают реакцией между соответствующими простыми веществами и последующим растворением полученного вещества в воде (физический процесс), например:
При растворении газа H 2 S в воде получается раствор сероводородной кислоты.
О б л а с т и п р и м е н е н и я. Кислоты применяют в технике, в пищевой отрасли промышленности, в медицине, для производства товаров бытовой химии, в химическом синтезе для получения новых веществ.
Тест по теме «Кислоты»
1. Укажите самую слабую из перечисленных кислот:
а) сероводородная; б) серная;
в) селеновая; г) сернистая.
2. Среди перечисленных наборов веществ укажите тот, в котором есть вещества, реагирующие друг с другом:
а) сульфид железа(II) и сульфид свинца;
б) сульфат натрия и хлорид бария;
в) гидроксид калия и гидроксид железа(II);
г) карбонат калия и серная кислота.
3. Формула высшего оксида элемента Х 2 О 3 . Какая из перечисленных кислот может соответствовать этому оксиду?
а) Н 2 Х 4 О 7 ; б) Н 2 Х 2 О 3 ; в) Н 2 ХО 4 ; г) Н 4 Х 2 О 6 .
4. Какое вещество под действием соляной кислоты превращается в хлорид меди(II)?
а) медь; б) бромид меди(II);
в) оксид меди(II); г) сульфат меди(II).
5. Ортофосфорная кислота реагирует с:
а) медью при нагревании;
б) аммиаком;
в) гидроксидом калия;
г) нашатырным спиртом.
6. Кислота, которая не может образовывать кислые соли, это:
а) сернистая; б) уксусная;
в) угольная; г) азотистая.
7. Простое вещество содержит элемент Х, входящий в состав щитовидной железы. При взаимодействии Х с газообразным веществом Y образуется сильная кислота Z. Эта кислота вступает в реакцию обмена с нитратом драгоценного металла с образованием желтого осадка. Кислота Z называется:
а) сероводородная; б) хлороводородная;
в) йодоводородная; г) бромоводородная.
8. В четырех пробирках находятся водные растворы сульфита, сульфида, сульфата и силиката натрия. С помощью какого одного реактива можно определить эти вещества?
а) Гидроксид натрия; б) соляная кислота;
в) хлорид бария; г) фенолфталеин.
9. В состав средства для удаления накипи («антинакипина») входят:
а) щелочи; б) пищевая сода;
в) кислоты; г) все перечисленное.
10. Смешали 0,5 л 7%-й серной кислоты ( = 1,046 г/мл) и 150 г 25%-й серной кислоты. Массовая доля (в %) кислоты в полученном растворе составляет:
а) 10; б) 11; в) 40; г) 48.
Ключ к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| а | б, г | а | в | б, в, г | б, г | в | б | в | б |
Задачи на кристаллогидраты
У р о в е н ь А
1. 5 г медного купороса растворили в 5 моль воды. Рассчитать массовую долю соли в полученном растворе.
Дано:
m(CuSO 4 5H 2 O) = 5 г,
(H 2 O) = 5 моль.
Найти:
Решение
(CuSO 4 5H 2 O) = m (CuSO 4 5H 2 O)/M (CuSO 4 5H 2 O) = 5/250 = 0,02 моль,
(CuSO 4) = (CuSO 4 5H 2 O) = 0,02 моль;
m (CuSO 4) = (CuSO 4)М (CuSO 4) = 0,02 160 = 3,2 г;
(CuSO 4)
= m
(CuSO 4)/m
(р-ра) = = 0,0337, или
3,37%.
Ответ . 3,37%.
2. Для приготовления 5%-го раствора сульфата магния взято 400 г его гептагидрата. Найти массу полученного раствора.
Ответ . 3,9 кг.
3. Определить массовую долю сульфата меди в растворе, полученном при растворении 50 г медного купороса в 450 г воды.
Ответ . 6,4%.
4. В какой массе воды нужно растворить 25 г медного купороса для получения 8%-го раствора соли?
Ответ . 175 г.
5. Какую массу декагидрата сульфата натрия нужно растворить в 800 г воды, чтобы получить 10%-й раствор соли?
Ответ . 234,6 г.
6. Определить формулу кристаллогидрата хлорида кальция, если 2,22 г безводной соли образует с водой 4,38 г кристаллогидрата.
Ответ . Гексагидрат CaCl 2 6H 2 O.
7. Содержание кристаллизационной воды в кристаллогидрате сульфата железа(II) составляет 45,32% его массы. Определить формулу этого кристаллогидрата.
Ответ . Гептагидрат FeSO 4 7H 2 O.
8. Какова процентная концентрация раствора хлорида кальция, полученного растворением 21,9 г его гексагидрата в 100 мл воды?
Ответ . 9,1%.
9. Определить состав кристаллогидрата сульфата натрия, если известно, что при нагревании 80,5 г кристаллогидрата до 300 °С масса испарившейся воды составила 45 г. Какова массовая доля раствора, полученного при растворении 80,5 г данного криталлогидрата в 2 л воды?
Ответ . Декагидрат Na 2 SO 4 10H 2 O; = 1,7%.
У р о в е н ь Б
1. 27,84 г частично обезвоженной кристаллической соды с избытком соляной кислоты выделяет 2,683 л (н.у.) углекислого газа. Найти формулу частично обезвоженной соды. Определить, сколько процентов воды потеряла кристаллическая сода при частичном обезвоживании.
Ответ . Гептагидрат Na 2 CO 3 7H 2 O; 18,9%.
2. При растворении 28 г неизвестного металла в разбавленной серной кислоте выделяется 11,2 л газа и образуется сульфат металла, из которого получается 139 г кристаллогидрата. Определить формулу полученного кристаллогидрата.
Ответ . Гептагидрат FeSO 4 7H 2 O.
3. Смесь кристаллогидратов медного и железного купоросов массой 3,89 г растворили в воде и добавили к раствору избыток хлорида бария. Выпало 3,5 г осадка. Определить состав исходной смеси.
Ответ
. 64,3% CuSO 4 5H 2 O
и 35,7% FeSO 4 7H 2 O.
4. Из 500 г 40%-го раствора сульфата железа(II) при охлаждении выпало 100 г его гептагидрата. Какова массовая доля вещества в оставшемся растворе?
Ответ . 36,3%.
5. Какую массу тетрагидрата нитрата кальция нужно растворить в 75 г 2%-го раствора нитрата кальция для получения раствора с молярной концентрацией 0,948 моль/л ( = 1,11 г/мл)?
Ответ . 16,2 г.
6. К 400 мл раствора дихромата натрия с концентрацией 0,238 моль/л ( = 1,041 г/мл) добавили 40 г кристаллогидрата этой соли. Массовая доля соли в растворе стала равна 13,17%. Установить состав кристаллогидрата.
Ответ . Дигидрат Na 2 Cr 2 O 7 2H 2 O.
7. Необходимо приготовить 1 кг 20%-го раствора соли. Сколько граммов ее кристаллогидрата и воды потребуется для этого, если известно, что в кристаллогидрате соли содержится на 79,5% больше, чем воды?
Ответ
. 222,84 г кристаллогидрата
и 777,15 г воды.
8. К 15%-му раствору ацетата свинца добавили 20 г кристаллогидрата этой соли. Полученный раствор имел массу 150 г и содержал 24,43% ацетата свинца. Установить формулу кристаллогидрата.
Ответ . Тригидрат Pb(CH 3 COO) 2 3H 2 O.
9. К 200 г 20%-го раствора нитрата цинка добавили 40 г кристаллогидрата этой соли. Концентрация соли в полученном растворе составила 27,27%. Установить формулу кристаллогидрата.
Ответ . Гексагидрат Zn(NO 3) 2 6H 2 O.
10. Дана смесь, в которой количества веществ хлорида натрия и кристаллогидрата бромида натрия равны между собой. Массовая доля поваренной соли в смеси составляет 29,6%. Установить состав кристаллогидрата.
Ответ . Дигидрат NaBr 2H 2 O.
11. Чтобы получить смесь оксида хрома(III) и кристаллогидрата сульфата хрома(III) с равными массовыми долями этих двух соединений, количество вещества оксида было взято в 4,71 раза больше, чем кристаллогидрата. Установить состав кристаллогидрата.
Ответ . 6,75%.
13. Какой объем 5%-го раствора сульфата натрия надо взять, чтобы растворение в нем 150 г декагидрата сульфата натрия привело к образованию 14%-го раствора? Плотности растворов равны соответственно 1,044 г/мл и 1,131 г/мл.
Ответ . 480,5 мл.
Продолжение следует


